查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
在上一期干货分享中我们介绍了铁死亡过程中脂质过氧化关键酶-脂氧合酶LOXs家族相关基因,本期我们将目光聚焦于在铁死亡中与LOXs协同作用并为LOXs发挥脂质过氧化作用提供底物的ACSLs家族相关基因。ACSLs(长链酰基辅酶A合成酶)家族是一类催化长链脂肪酸(LCFAs)与辅酶A(CoA)结合的酶,生成的长链脂肪酸酰基辅酶A(LCFA-CoA)是脂肪酸代谢的关键中间体,参与氧化、合成及信号转导等多种生物学过程。ACSLs家族成员在不同组织和疾病中具有差异化的功能,尤其在癌症、代谢疾病和神经炎症中表现出复杂的调控作用。

1.ACSLs家族概况
在哺乳动物中,ACSLs家族包含五个成员,分别是ACSL1、ACSL3、ACSL4、ACSL5和ACSL6。ACSL1于1953年被首次报道,ACSL3至ACSL6随后陆续被发现[1]。ACSLs以CoA作为辅因子,将LCFAs(链长为12-20个碳的脂肪酸)[2] 催化为LCFA-CoA,LCFA-CoA随后会参与自身修饰过程,包括链的延长、去饱和以及蛋白质修饰等过程(图1)。此外,ACSLs对于合成代谢过程(包括甘油脂、磷脂以及胆固醇酯的生物合成)和分解代谢途径(包括脂肪酸氧化)都是不可或缺的。
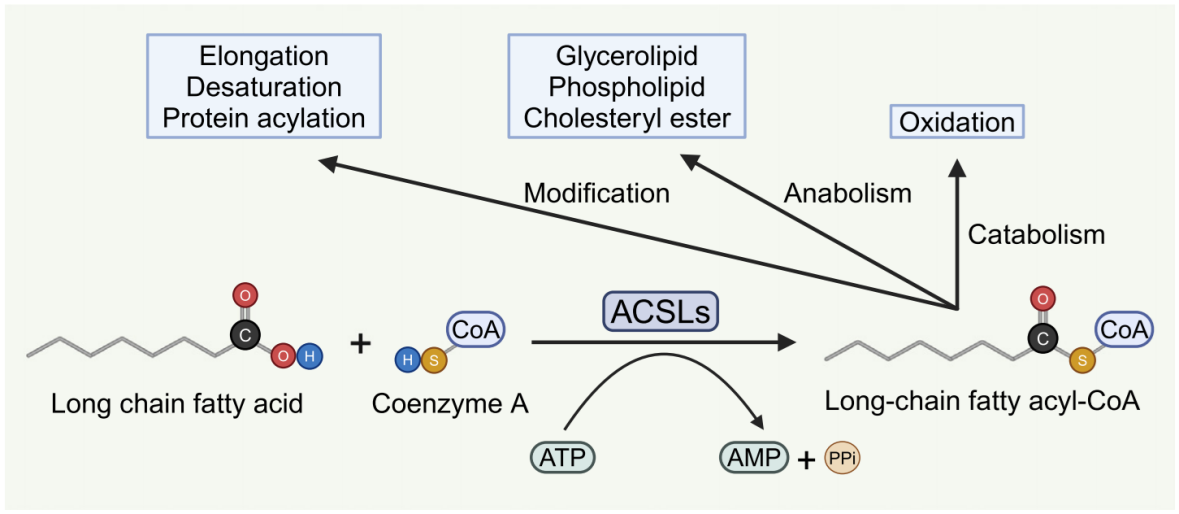
图1. ACSLs催化LCFAs反应及其产物代谢去向
根据底物和序列相似性,ACSLs可分为两个亚族,其中ACSL1、ACSL5和ACSL6为一个亚族,ACSL3和ACSL4为另一个亚族[3]。每个ACSL家族成员都有其偏好的长链脂肪酸底物,例如棕榈酸(PA)、棕榈油酸(POA)、硬脂酸(SA)、油酸(OA)、亚油酸(LA)、花生四烯酸(AA)、肾上腺酸(AdA)、二十碳五烯酸(EPA)以及二十二碳六烯酸(DHA)等。不同的ACSLs也会催化相同的底物,它们在长链脂肪酸代谢中具有功能冗余性及相互补偿的特点。
除了底物偏好有所不同之外,ACSLs在组织分布以及亚细胞定位方面也存在差异(图2),ACSL1在肝脏、肌肉中高表达;ACSL3和ACSL6主要在大脑、肌肉和睾丸中表达;ACSL4在肾上腺中大量表达,而ACSL5主要在肝脏、肺和肠黏膜中表达[4]。
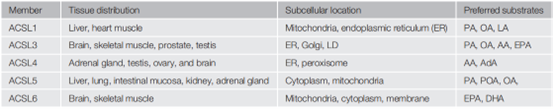
图2. ACSLs家族各成员表达分布及催化底物
2.ACSLs家族与铁死亡
LCFAs是铁死亡的主要调节因子,它通过调节磷脂中脂肪酰基链的过氧化潜能来发挥作用。LCFAs根据其不饱和键的数量可分为多不饱和脂肪酸(PUFAs)和单不饱和脂肪酸(MUFAs)。含有两个及以上不饱和键的PUFAs极易发生过氧化,因此当它们结合到磷脂中时会促进铁死亡。相反,仅有一个不饱和键的MUFAs不易受到氧自由基的攻击,更可能抑制铁死亡。LCFAs必须先被活化成LCFA-CoA才能结合到磷脂中。因此,ACSLs催化的长链脂肪酸活化是诱导铁死亡的起始因素[4]。
(1)ACSL4:铁死亡的核心驱动者
ACSL4是与铁死亡关系最为密切的脂质代谢酶。ACSL4的过表达会导致包括AA/AdA在内的多种PUFAs被催化,从而改变细胞脂质组成,并增加细胞对铁死亡的易感性。一般来说,在铁死亡过程中,AdA和AA首先由ACSL4活化,随后在与内质网相关的氧化中心形成AdA-CoA和AA-CoA衍生物[5]。接着,AdA-CoA和AA-CoA由LPCAT3整合到磷脂中,从而生成含有可氧化多不饱和脂肪酸的磷脂(PUFA-PLs);最后,这些PUFA-PLs会在LOX、POR或PEBP1所催化的反应中发生过氧化,进而引发铁死亡[4]。
有研究团队对小鼠进行大脑中动脉闭塞(tMCAO)手术后,通过向其左脑注射ACSL4过表达慢病毒,证实了ACSL4的过表达会导致小鼠大脑梗死面积增大且神经功能下降,并最终导致大量神经毒性因子(如活性氧物质ROS)的释放。在脑缺血/再灌注模型中,敲低ACSL4可减轻缺血性脑损伤,而ACSL4过表达则会加剧缺血性脑损伤。可见,ACSL4能够通过促进铁死亡导致神经元死亡;因此,通过药理学或遗传学手段抑制ACSL4,阻止AA/AdA酯化为磷脂酰乙醇胺(PE),是对抗铁死亡的一种特定方法。ACSL4也是肿瘤治疗的一个潜在靶点,有研究表明它可通过激活铁死亡通路抑制胶质瘤细胞的增殖[6]。此外,肿瘤细胞中ACSL4的转录可受许多信号调控,这些信号会使肿瘤细胞对铁死亡产生抗性或变得敏感。在具有间充质或转移特性的肿瘤细胞中,失活的NF2可通过YAP上调ACSL4的转录,从而促进铁死亡的发生。然而,AIM2、LSD1、RB1、CPT1A以及整合素α6β4可直接或间接抑制ACSL4的转录,进而阻止肿瘤细胞发生铁死亡。此外,电离辐射也会上调ACSL4的转录并促进铁死亡。多项研究也发现ACSL4的翻译后修饰(PTMs),包括磷酸化、甲基化和泛素化也可影响铁死亡。如PCK2可在T679位点对ACSL4磷酸化,导致脂质过氧化增强以及铁死亡加剧;CDK1可磷酸化ACSL4的S447位点,进而招募UBR5促进其泛素化,导致其降解;CARM1可对ACSL4的R339位点产生甲基化,导致由RNF25介导的泛素化增加而使ACSL4降解;总之,ACSL4蛋白的高度动态且复杂的翻译后修饰也影响着细胞铁死亡[4]。
(2)ACSL3:铁死亡抗性的介导者
ACSL3介导的对铁死亡的抗性源于其对OA这种单不饱和脂肪酸的代谢偏好。ACSL3可促进OA转化为OA-CoA,之后,MBOAT1和MBOAT2对其进行催化,使其整合到膜磷脂中。通过这一过程,能够减少细胞膜内可氧化的PUFA-PLs的含量,进而诱导产生对铁死亡的抗性。Magtanong等人[7]的研究发现,外源性 MUFAs处理能够在数小时内降低细胞膜脂质对致死性氧化的敏感性,并且这一过程需要ACSL3对MUFAs进行激活,提高了细胞对铁死亡的抵抗。
研究发现ACSL3介导的OA代谢在两种不同的肿瘤模型中均能抑制肿瘤细胞的铁死亡。在淋巴转移的情况下,位于淋巴结中的黑色素瘤细胞会利用富含OA的淋巴液,以ACSL3依赖的方式逃避铁死亡,进而导致转移增加。同样,在三阴性乳腺癌(TNBC)模型中,ACSL3利用乳腺脂肪细胞分泌的OA来赋予细胞铁死亡抗性[4]。但是另有研究发现抑制ACSL3可降低肾透明细胞癌(ccRCC)细胞对铁死亡的敏感性[8],这可能与ACSL3在该肿瘤细胞模型中更倾向于PUFAs代谢而非OA代谢的偏向性有关。说明ACSL3在不同微环境下可能存在不同的代谢机制,其在铁死亡调控方面的作用也有待进一步研究。
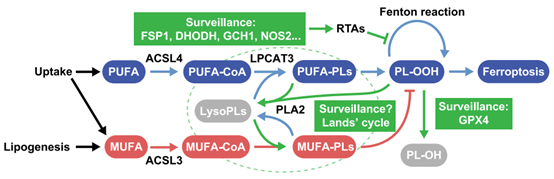
图3. ACSL4和ACSL3与铁死亡[9]
(3)ACSL1:铁死亡中的“双面”角色
关于ACSL1在铁死亡中的作用机制仍有待进一步解析。研究发现ACSL1可通过增加铁死亡抑制蛋白1(FSP1)的肉豆蔻酰化,来抑制活性氧ROS并抵抗铁死亡,进而使卵巢癌细胞产生铁死亡耐受性和铂类药物的耐药性[10]。然而在三阴性乳腺癌(TNBC)细胞系中,ACSL1可催化α-桐油酸(αESA,一种由某些植物产生的多不饱和脂肪酸)整合到诸如甘油三酯(TAG)和甘油二酯(DAG)等中性脂质中,从而引发铁死亡[11]。原因可能是αESA衍生的酰基链在中性脂质中的氧化分解充当了膜磷脂过氧化的催化剂,而膜磷脂过氧化是铁死亡过程中的一个关键环节;因此,阐明氧化的中性脂质如何传播并最终导致膜磷脂过氧化的机制是十分必要的。总的来说,ACSL1对于铁死亡的差异作用可能是由于对内源性LCFA和外源性LCFA底物的代谢作用不同所导致的,其具体作用机制还有待深入研究。
(4)ACSL5 与 ACSL6:铁死亡中作用仍待解析
ACSL5和ACSL6在铁死亡中的功能尚未明确[4]。有研究报道在肝细胞癌中,ACSL5可增强脂质过氧化,并调节肿瘤细胞对铁死亡诱导剂的敏感性。ACSL5对铁死亡的另一种潜在影响在于,它可受到溶血磷脂酰胆碱(lysoPC,一种参与膜脂质重塑的磷脂)的转录促进作用。此外,ACSL5与神经酰胺或棕榈酸之间的代谢相关性表明,ACSL5与铁死亡之间可能存在相互作用。脑组织中含量最丰富的ACSL6对DHA表现出较高的代谢偏好。DHA易于发生过氧化反应,因此可能与铁死亡存在潜在关联。然而,在前列腺癌细胞中,DHA诱导的铁死亡似乎与ACSL6并无明确关联。所以,神经系统疾病中的铁死亡与ACSL6-DHA代谢之间的关系仍有待进一步探究。
总体而言,ACSLs家族成员在铁死亡调控网络中占据重要地位,深入研究其作用机制,不仅有助于深化对铁死亡这一复杂生物学过程的理解,更为相关疾病的治疗提供了极具潜力的靶点和全新策略,未来在基础研究与临床应用方面具有广阔的前景。1066vip威尼斯专营病毒包装十余载,建立了庞大的基因研究现货工具库,现可提供ACSLs家族基因相关过表达产品,也可定制靶向特异性组织或细胞的基因调控工具,包括慢病毒(Lentivirus,LV)、腺病毒(Adenovirus,AD)、腺相关病毒(Adeno-associated-virus,AAV)以及质粒等,如有技术或产品需求,欢迎随时咨询1066vip威尼斯微信公众号或拨打官网技术服务热线:400-092-0065。本期内容到这里就结束了,下期我们将会继续分享表观遗传修饰相关的内容,敬请关注!
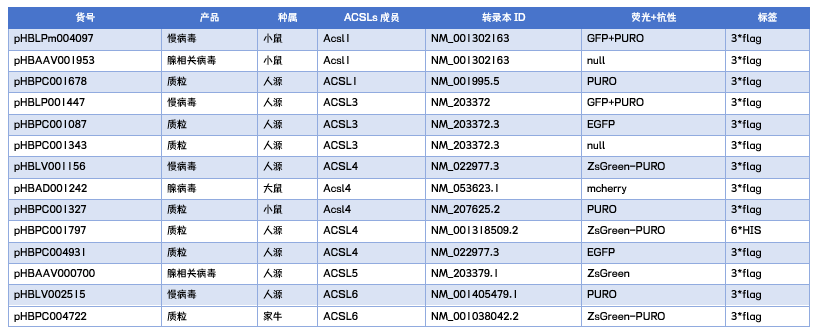
表1 1066vip威尼斯ACSLs相关现货
参考文献:
[1] Suzuki H, Kawarabayasi Y, Kondo J, et al. Structure and regulation of rat long-chain acyl-CoA synthetase. J Biol Chem. 1990;265(15):8681-8685.
[2] Soupene E, Kuypers FA. Mammalian long-chain acyl-CoA synthetases. Exp Biol Med (Maywood). 2008;233(5):507-521. doi:10.3181/0710-MR-287
[3] Zhao C, Liu G, Shang S, et al. Adaptive evolution of the ACSL gene family in Carnivora. Genetica. 2019;147(2):141-148. doi:10.1007/s10709-019-00057-3
[4] Lin J, Lai Y, Lu F, Wang W. Targeting ACSLs to modulate ferroptosis and cancer immunity. Trends Endocrinol Metab. Published online October 17, 2024. doi:10.1016/j.tem.2024.09.003
[5] Jia B, Li J, Song Y, Luo C. ACSL4-Mediated Ferroptosis and Its Potential Role in Central Nervous System Diseases and Injuries. Int J Mol Sci. 2023;24(12):10021. Published 2023 Jun 12. doi:10.3390/ijms241210021
[6] Jia B, Li J, Song Y, Luo C. ACSL4-Mediated Ferroptosis and Its Potential Role in Central Nervous System Diseases and Injuries. Int J Mol Sci. 2023;24(12):10021. Published 2023 Jun 12. doi:10.3390/ijms241210021
[7] Magtanong L, Ko PJ, To M, et al. Exogenous Monounsaturated Fatty Acids Promote a Ferroptosis-Resistant Cell State. Cell Chem Biol. 2019;26(3):420-432.e9. doi:10.1016/j.chembiol.2018.11.016
[8] Klasson TD, LaGory EL, Zhao H, et al. ACSL3 regulates lipid droplet biogenesis and ferroptosis sensitivity in clear cell renal cell carcinoma. Cancer Metab. 2022;10(1):14. Published 2022 Oct 3. doi:10.1186/s40170-022-00290-z
[9] Liang D, Minikes AM, Jiang X. Ferroptosis at the intersection of lipid metabolism and cellular signaling. Mol Cell. 2022;82(12):2215-2227. doi:10.1016/j.molcel.2022.03.022
[10] Zhang Q, Li N, Deng L, et al. ACSL1-induced ferroptosis and platinum resistance in ovarian cancer by increasing FSP1 N-myristylation and stability. Cell Death Discov. 2023;9(1):83. Published 2023 Mar 8. doi:10.1038/s41420-023-01385-2
[11] Beatty A, Singh T, Tyurina YY, et al. Ferroptotic cell death triggered by conjugated linolenic acids is mediated by ACSL1. Nat Commun. 2021;12(1):2244. Published 2021 Apr 14. doi:10.1038/s41467-021-22471-y

查看更多

查看更多

查看更多

联系我们

返回顶部